saiba mais
-
Cresce número de mulheres infectadas com HIV em relações estáveis
-
Pesquisadores traçam a rota de disseminação do HIV
-
HIV: autoridades de saúde reclamam que preservativos são muito pequenos para os ugandenses
-
HIVBr18: conheça a vacina brasileira da Aids
-
Pesquisadores descobrem que droga anti-HIV protege também a retina
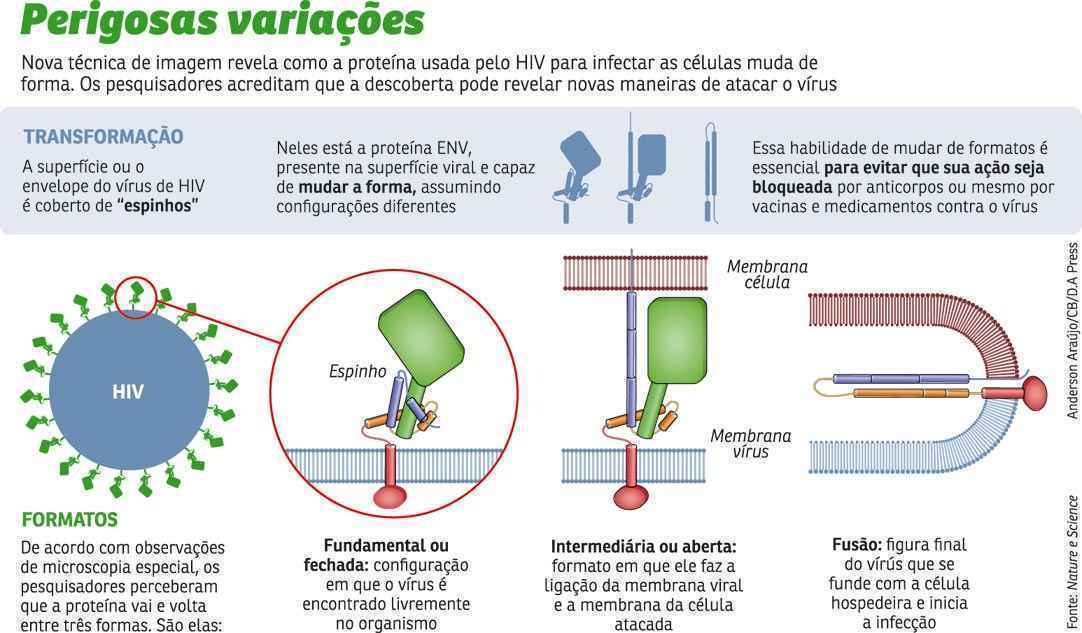
O trabalho é publicado simultaneamente com um artigo na revista Science feito por James Munro, da Escola de Medicina da Universidade de Yale (EUA), com conclusões semelhantes. Já era conhecido que, antes de as membranas das células virais e do corpo humano se fundirem, a proteína da superfície do HIV pode mudar de formato. Essas transformações são essenciais para fugir dos anticorpos e também uma característica que torna o HIV um micro-organismo de difícil tratamento. O princípio é simples. A superfície da célula trabalha com o sistema de chave e fechadura. Para uma partícula, uma substância ou uma patógeno entrar nela, é preciso que tenha um formato específico (chave) que encaixe perfeitamente com um dos receptores (ou uma das fechaduras).
O HIV tem uma chave que encaixa em uma das fechaduras da célula humana, porém, segundo os dois novos estudos, ele é capaz de mudar esse formato para enganar os anticorpos que buscam uma chave específica para combater. O artigo de Munro detalha uma nova técnica de imagiologia microscópica que apresenta a atividade de transformação do vírus, enquanto Kwong estuda como são os espinhos virais antes de se associarem à célula-alvo. Com isso, ambos buscam responder à mesma pergunta: como o HIV foge da resposta imune da célula?
Kwong relata que, antes de entrar em um hospedeiro, a proteína altera o seu formato em três formas (veja arte). A equipe liderada por ele estudou como essas configurações se alteraram quando duas moléculas isoladas de HIV— uma sensível aos anticorpos e uma resistente a eles — se ligam a células humanas. Inicialmente, as duas ocuparam as chamadas configurações de estado fundamental. Mas as sensíveis aos anticorpos, na presença de um eles, mudam e passam mais tempo em uma configuração intermediária, mais vulnerável.
Eles tentaram entender também como os anticorpos amplamente neutralizantes (ou bNAbs), mais eficazes contra o HIV, agem diante do bloqueio da proteína da superfície do HIV no estado fundamental. Descobriram que, junta aos bNAbs, essa proteína adota a forma do estado fundamental, explicando por que esses anticorpos — descobertos em alguns pacientes com Aids — oferecem proteção contra a doença. “Esse trabalho sugere que a estabilização desse estado representa uma estratégia eficaz para antagonizar a máquinas de fusão viral”, afirma Munro. As conclusões foram igualmente percebidas por Kwong. Os espinhos vistos por ele nas imagens em altíssima resolução também são responsáveis por facilitar a entrada do vírus nas células.
Ambos os cientistas acreditam que a análise da estrutura viral pode ajudar na concepção de vacinas que desencadeiam respostas imunitárias protetoras. “A estrutura do HIV descrita por nós revela não apenas pontos comuns de entrada e evasão com outro tipo de maquinário de fusão, mas também semelhanças no reconhecimento pelo sistema imunológico humano. Ainda é preciso avaliar se uma vacina eficaz contra o HIV pode ser desenvolvida usando o detalhe a nível atômico fornecido aqui, o que deve, com certeza, permitir o desenvolvimento de estratégias imunológicas”, analisa Kwong.