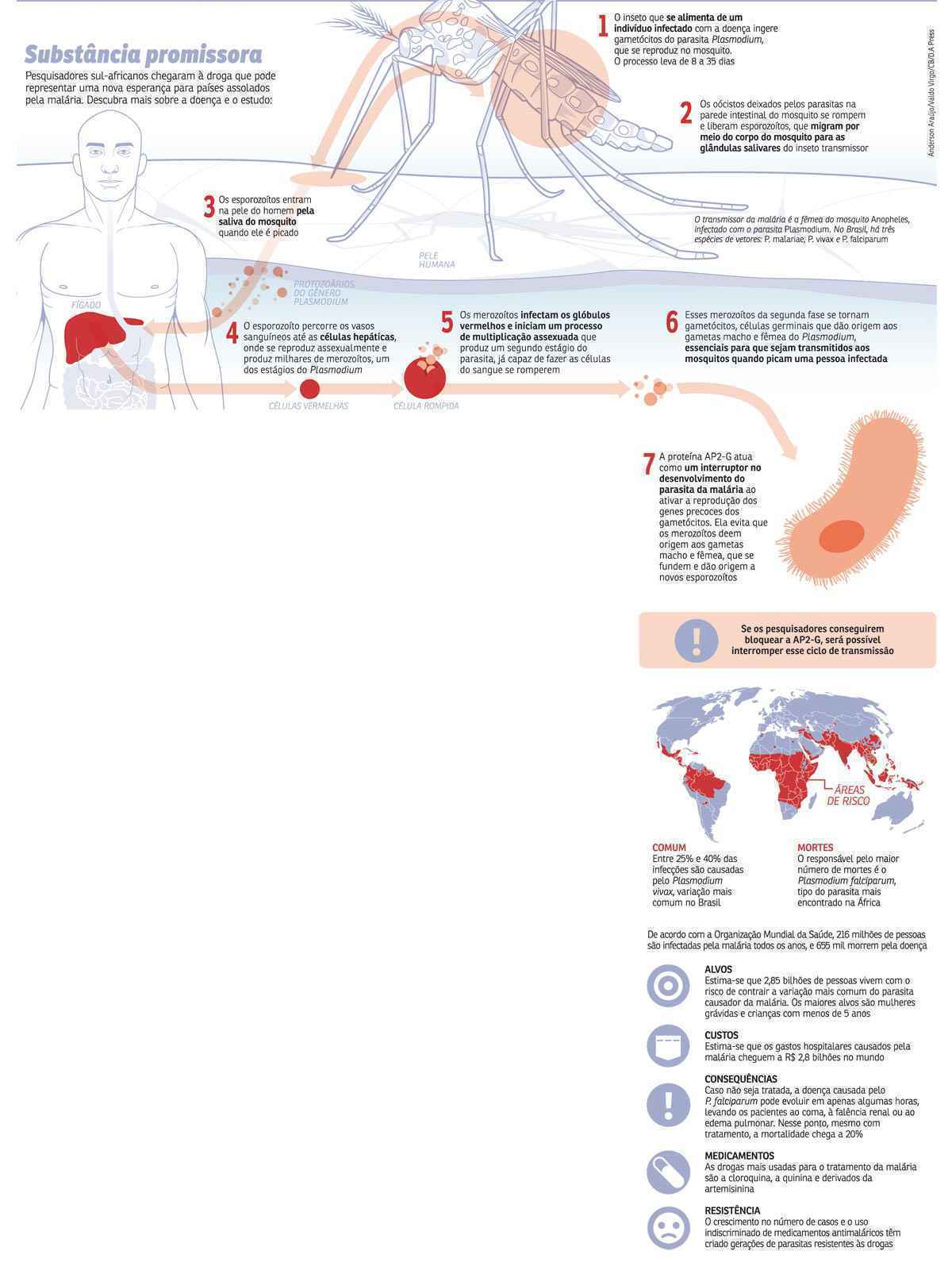
“O bloqueio dessa proteína poderia evitar a formação do gametócito, que não infectaria o mosquito quando ele picasse uma pessoa com malária. Muitas vezes, os doentes apresentam resistência ao tratamento, e o parasita não morre. Esse método seria uma outra alternativa porque ele simplesmente impediria o desenvolvimento do parasita, o que evitaria que a transmissão acontecesse”, explica o infectologista Pedro Luiz Tauil, professor da Faculdade de Medicina da Universidade de Brasília (UnB). A malária é causada por seres unicelulares chamados Plasmodium. Para sobreviver e se reproduzir, esses parasitas desenvolvem um sistema complexo, composto por três etapas principais.
saiba mais
-
OMS registra redução de casos da malária, mas desafios permanecem
-
Criada vacina 100% eficaz contra a malária
-
Estudo descarta risco de malária em crianças que ingerem ferro
-
OMS deve aprovar primeira vacina contra malária em 2015
-
Indústria francesa anuncia primeiro medicamento semissintético contra a malária
-
Novartis anuncia resultados promissores de novo tratamento contra malária
-
Descoberto o esconderijo do causador da malária
-
Cientistas descobrem anticorpo que encarcera parasita da malária
Surpreendentemente, na segunda etapa, quando o homem mais sofre com o mal-estar, a malária não pode ser transmitida aos mosquitos. Para que a transmissão se dê, deve existir a diferenciação dos gametócitos sexuais (veja infográgico), duas formas estruturalmente diferentes e que têm um programa de expressão gênica e protéica única. Após se unirem, os machos e as fêmeas formam o agente infeccioso da doença. Felizmente, os parasitas da malária produzem apenas um pequeno número componentes sexuais por ciclo. De 1% a 4% dos causadores da doença alcançam a forma sexuada, que é induzida pela ação da AP2-G.
“Agora, temos oportunidades interessantes para encontrar uma forma eficaz de quebrar a cadeia de transmissão da malária pelo parasita antes que ele complete o ciclo de vida completo”, comemora Manuel Llinás, professor da Universidade de Princeton e Penn State. Llinás é o líder de uma equipe internacional de cientistas que descreve como o regulador transcricional AP2-G age. Os grupos trabalharam com dois tipos de parasitas da malária, o Plasmodium falciparum, que causa as formas mais severas da doença, e o Plasmodium berghei, um modelo muito estudado em infecções de roedores.
Os estudos espanhóis foram iniciados em Barcelona, quando os pesquisadores do Cresib descobriram que clones de cepas da malária humana tinham níveis de AP2-G distintos. Essa diferença podia ser vista, inclusive, quando os parasitas alcançavam a etapa sexual de formação. “Os resultados são surpreendentes porque estávamos encontrando enormes diferenças no número de parasitas no estágio sexual produzidos por diferentes linhas de células”, contou Llinás .
Outras experiências mostraram que o nível atual de parasitas em estágio sexual gerados por um clone combinava com a proporção de células individuais que produzem a proteína AP2 -G. Os clones compartilhavam DNA idêntico, mas os descendentes deles produziam quantidades divergentes de parasitas em estágio sexual. Isso fez com que a Llinás suspeitasse que esse fenômeno poderia ser resultado da ação de um mecanismo fora dos genes e que fosse diferente de uma mutação na sequência do DNA. “Sabíamos que a AP2-G era usada para iludir os mecanismos do sistema imune do hospedeiro, mas, agora, descobrimos que esses mecanismos epigenéticos regulam muitos outros processos do desenvolvimento do parasita da malária, incluindo a diferenciação sexual”, comemorou o pesquisador.
Em outra linha separada de investigação, David Baker e Taane Clark, ambos da Faculdade de Doenças Tropicais da Escola de Medicina Tropical e Higiene de Londres, estudaram cepas do Plasmodium incapazes de gerar gametócitos. Baker, que estuda como se dá a diferenciação sexual do parasita da malária há mais de 20 anos, observou que, nessas cepas, a AP2-G era desativada. Um outro estudo paralelo com parasitas de malária que atacam roedores e perderam a capacidade de desenvolver o estágio sexual encontrou os mesmo resultados.
Para confirmar essas observações, todos os laboratórios resolveram desligar a ação da proteína e os parasitas manipulados acabaram perdendo a capacidade de gerar outros em estágio sexual. No entanto, assim que os genes foram reparados com terapia genética, a capacidade de gerar gametócitos reapareceu.
Combinado com outros experimentos, os resultados mostraram o estágio sexual em parasitas da malária são produzidos somente quando a proteína AP2 -G está em boas condições de funcionamento. “Nossa pesquisa inequivocamente demonstrou que essa proteína é o interruptor que inicia a transformação de parasitas da malária no sangue a partir da fase assexuada para a fase crítica do seu ciclo de vida”, confirmou Llinás.
Todos os grupos concordam que as descobertas são emocionantes para o futuro da investigação sobre a malária, mas ainda faltam estudos que consigam mostrar como bloquear a ativação da proteína. “Com a ajuda das tecnologias que nós e outros pesquisadores da malária estamos usando, estamos otimistas para encontrar um melhor controle da malária, quem sabe, dentro dos próximos cinco anos”, aposta Llinás .