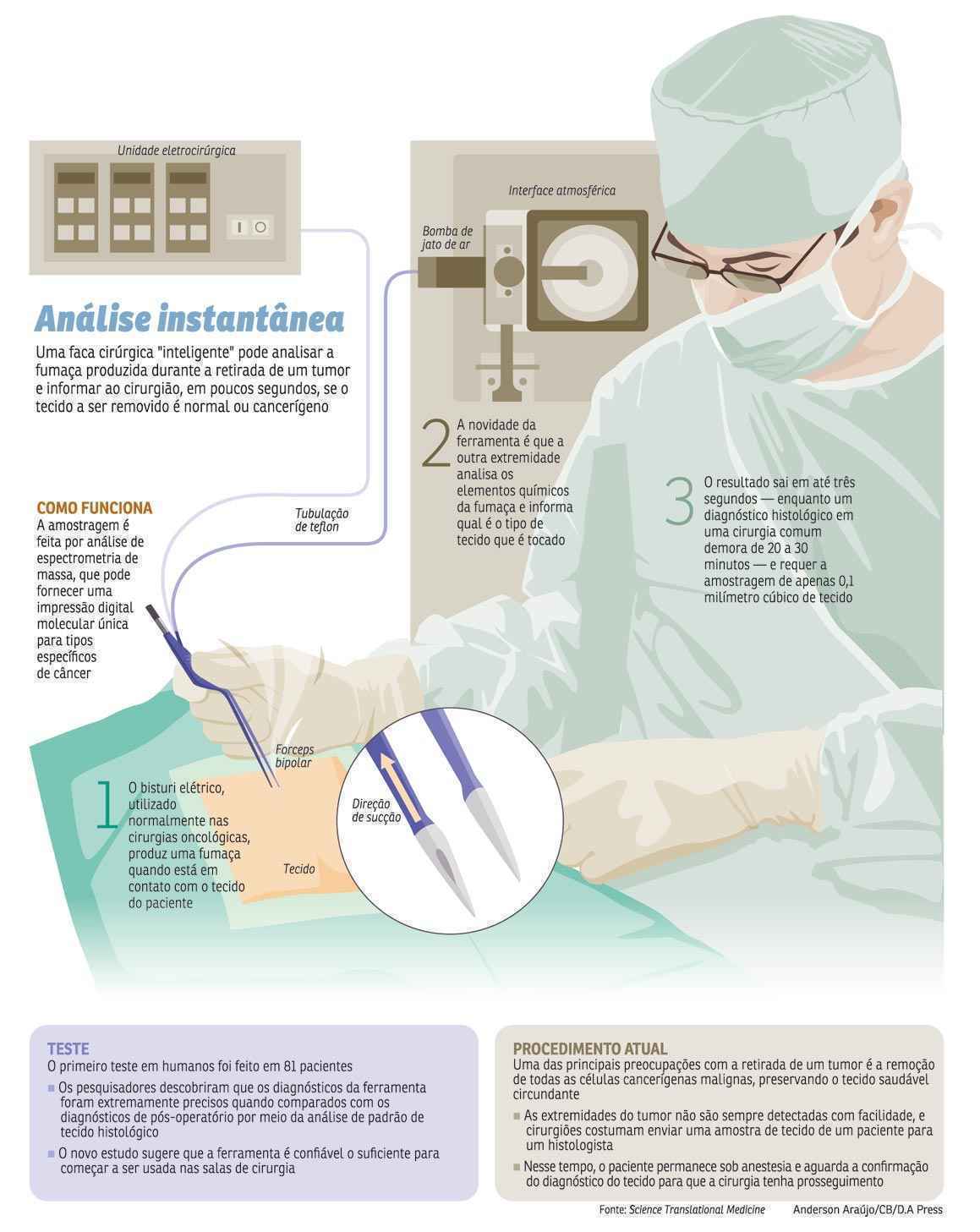
Atualmente, a forma mais segura de identificar com precisão as margens do tumor a ser removido é por meio de um exame histológico. Nele, uma amostra é retirada do paciente e, em seguida, examinada por um médico patologista. Durante esse período, que normalmente dura de 20 a 30 minutos, o paciente permanece anestesiado no centro cirúrgico. A ferramenta criada pela equipe da Universidade de Debrecen, na Hungria, e da Faculdade Imperial de Londres, no Reino Unido, utiliza uma abordagem baseada na espectrometria de massa — um método que identifica os diferentes átomos que compõe uma substância — para avaliar o tipo de tecido a ser cortado.
A técnica é capaz de fornecer uma impressão digital molecular única para tipos de câncer, especificamente a chamada de espectrometria em massa da ionização rápida da evaporação (Reims, em inglês). Ela permite a caracterização quase em tempo real do tecido em indivíduos com o tumor por meio de análise da fumaça liberada durante a dissecção eletrocirúrgica. Os pesquisadores apelidaram o instrumento de iKnife (faca inteligente, em inglês) por unir a tecnologia Reims com a eletrocirurgia.
O objetivo do grupo era buscar uma nova forma de garantir que todo o tecido maligno fosse removido, já que a dificuldade de identificação das bordas ou das margens tumorais pode fazer com que o paciente permaneça com algumas células cancerígenas ainda no organismo, o que facilita a volta dos tumores. Após o desenvolvimento da ferramenta, os pesquisadores liderados por Zoltán Takás, da Faculdade Imperial de Londres, testaram o bisturi inteligente em amostras de tecidos cancerosos, saudáveis e benignos/inflamatórios. Uma variedade de amostras de tecidos de 302 pacientes foi analisada em laboratório, resultando em 1.624 exemplares não cancerígenos e 1.309 cancerígenos. Os experimentos permitiram a criação de um banco de dados com quase 3.000 espectros de massa ou “impressões digitais moleculares” únicas para cada tipo de câncer.
saiba mais
Os diagnósticos da ferramenta também foram extremamente precisos, quando comparados aos diagnósticos de pós-operatório por meio da análise histológica. Os pesquisadores sugerem que a ferramenta é confiável o suficiente para começar a ser usada nas salas de cirurgia. “A abordagem Reims diferenciou com precisão entre diferentes tipos histológicos e histopatológicos do tecido, com tecidos malignos produzindo características químicas específicas para os seus subtipos histopatológicos”, detalha Takás.
Para complementar
Na cirurgia tradicional, para que não fiquem células cancerígenas nos pacientes, são usados diversos artifícios, como o serviço de imagem, que mostra a localização dos órgãos, a relação deles com as estruturas adjacentes e marca o local em que será feito o corte. Há ainda o exame de congelação, que é o teste de histologia patológica tradicional. “A biópsia de congelação feita no momento da cirurgia por um patologista especializado indica se existem células microscópicas tumorais nas margens. Se a área estiver comprometida, é preciso aumentar o perímetro de remoção”, explica Felipe José Fernández Coimbra, cirurgião oncologista e diretor do Núcleo de Cirurgia Abdominal do Centro de Câncer A.C.Camargo.
“Esse estudo mostra, provavelmente, uma ferramenta que vai se somar a tudo isso. Não chega a substituir, pelo menos por enquanto, um exame de histologia de congelação durante a cirurgia, nem a técnica cirúrgica feita de forma adequada ou os exames de imagem”, avalia Coimbra.
O médico acredita que a ferramenta ainda precisa ser avaliada em outras instituições, com um grupo maior de pacientes e outros tipos de tumor. Outra coisa que o especialista também alerta é que cada vez mais o tratamento contra o câncer é combinado. “Às vezes, o paciente faz quimioterapia primeiro e depois opera, ou é submetido à radioterapia antes da cirurgia. O foco principal desse estudo não analisa esse detalhe. Uma químio ou uma radioterapia pode mudar um pouco os componente químicos.”
Coimbra avalia que a principal vantagem do bisturi inteligente é ser um exame seguro, capaz de analisar quase de imediato o tipo de tecido a ser cortado. “Então, é muito interessante, especialmente quando é preciso ter um cuidado extremo com tumores com múltiplas margens. Acho que, no futuro, tudo o que já existe hoje não vai ser substituído. Esse exame provavelmente entrará como mais um, favorecendo a segurança das margens dos princípios de cirurgia oncológica.”
Ação dupla
Para fazer a cirurgia oncológica, é usado um instrumento chamado bisturi elétrico, que emite energia elétrica em uma das extremidades. O objetivo é queimar ao mesmo tempo que corta, proporcionando a coagulação do tecido e evitando sangramento.

Combinação de fatores facilita os acertos
“A identificação de diagnósticos diferenciais permite o ajuste da melhor técnica cirúrgica e do melhor tratamento para o paciente, lembrando que a relação doença/paciente deve ser sempre considerada na decisão. Hoje, com uma equipe de cirurgia oncológica devidamente treinada e com um médico patologista disponível para o estudo rápido das características biológicas dos tecidos retirados, podemos decidir, com altíssimo grau de acerto, a melhor estratégia e o melhor tratamento para cada indivíduo. Fazemos isso com a análise direcionada de fatores prognósticos, como subtipos histológicos, distância de margens de segurança, número de linfonodos e características moleculares da lesão. Esses fatores necessitam da análise de células íntegras, do tecido viável e não ‘vaporizado’, o que ainda não é contemplado por essa tecnologia. Essa ainda não é uma ferramenta validada. Por isso, não pode ser utilizada em prática médica corrente, somente em ambiente de pesquisa, com devidas autorizações da instituição, equipe e, principalmente, do paciente."
Rodrigo Nascimento Pinheiro, presidente da Sociedade Brasileira de Cirurgia Oncológica – Regional DF e cirurgião oncológico do Hospital Santa Luzia